5-Fu血药浓度与药代动力学参数AUC分布除去个别患者退组者(因患者治疗后期依从性不高���,部分患者未进行后续治疗���,对照组3例���,实验组3例)���,37例对照组在6个周期内共计23次落在治疗窗(AUC: 20~30mg·h /L) 的患者比例为16.67%(23/138) ���,多数患者的5-Fu AUC值都低于治疗窗范围���。实验组基于 BSA 给药后��,患者的5-Fu血药浓度分布也比较分散���,第1周期落在治疗窗范围内的患者比例为21.6%(8/37) ��,其变异系数(CV) 48.77%���,经过2~6周期的剂量调整后���,到第6周期时比例提升到67.74%(23/34)���,其CV为22.75%��。两组间差异有统计学意义(χ2=20.04���,P<0.01) ���。对照组和实验组6个周期内5-Fu血药浓度分析结果见图 1��。
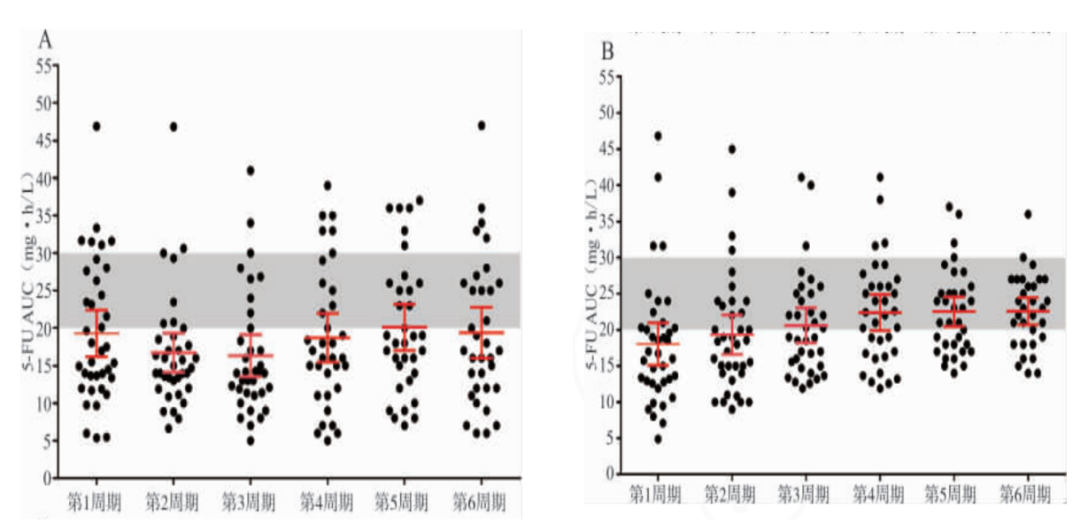
注:A���,对照组多数患者的5-Fu AUC 值低于治疗窗范围��。B���,实验组患者5-Fu血药浓度落在治疗窗范围内的数量增加���,且具有集中趋势[5]��。图 1 对照组和实验组患者6个周期 5-Fu AUC 分布情况
5-Fu毒副反应与剂量调整的关系与对照组[70.3%( 26 /37) ]相比���,实验组毒副反应(≥3级) 发生率[32.4% (12/37)]差异有统计学意义(χ2=10.60���,P<0.01) ���。进一步分析具体的毒副反应结果表明���,腹泻���、口腔黏膜炎等毒副反应的差异均有统计学意义(P均<0.05) ���,而恶心���、呕吐���、手足综合征���、食欲下降���、体重下降���、白细胞减少等差异均无统计学意义(P均>0.05)
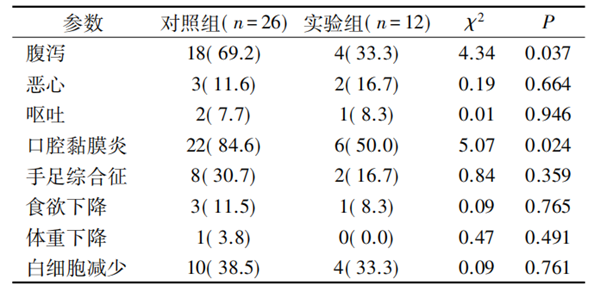
对照组与实验组毒副反应的关系[n(%)]
大量针对西方人群的临床试验[6-7]表明��,5-Fu的药理特性与临床毒性以及疗效具有明显的统计学相关性���,而体表面积给药剂量与疗效及总生存期差异均无统计学意义��。这些临床试验表明���,在结直肠癌治疗领域中���,通过对5-Fu常规血药浓度监测���,并根据每例患者的药理表征进行个体化剂量调节���,能够实现降低毒性���,增加治疗效果的目的���。5-Fu的有效治疗浓度范围(治疗窗) 非常窄���,患者对药物的代谢差异���,能引起个体药效学上的巨大差异��。因此���,临床迫切需要基于个体药理差异对5-Fu进行血药浓度监测及剂量调节[8]���。
通过本研究结果对比可知���,通过5-Fu血药浓度检测���,及时调整患者的用药剂量���,可以使实验组落在治疗窗范围内的患者比例明显增加��,表明通过药代动力学进行5-Fu的剂量管理是一种临床可行的操作���。改变用药剂量可能会带来化疗毒副反应增加的风险���,但是本研究结果表明���,通过剂量调整使得患者达到设定的治疗窗血药浓度范围���,不仅治疗的效果没有降低��,反而在整体的毒性控制更优于BSA给药方式��。此外��,本研究中以5-Fu为基础的肠癌治疗方案中���,在引起白细胞减少症方面差异无统计学意义(对照组为38.5%���,实验组为33.3%) ���,这与国外文献的报道的结论类似[9]���。
本研究亦证实通过监测患者化疗过程中的5-Fu血药浓度��,可以预估患者本次化疗的毒副反应发生情况���,尽早予以干预��。由于检测的是5-Fu在静脉持续滴注过程中的血药浓度��,因此���,可以根据及时的检测报告来预判本次5-Fu后续持续滴注过程中的代谢情况���,进而可以依据患者自身状态及检测结果适当的进行滴注持续时间的调整���,以控制化疗相关毒性反应或者提高化疗的疗效���。